
Leistungen
GxP – Pharma und Life-Science
GxP bezeichnet zusammenfassend alle Richtlinien der sogenannten ‚Guten Arbeitspraxis‘, welche in der Medizin, der Pharmazie und der pharmazeutischen Chemie Bedeutung haben. Das G steht für Gut(e), das x in der Mitte wird durch die jeweilige Abkürzung des spezifischen Anwendungsbereichs ersetzt, und das P steht für Praxis.
GxP - Pharma und Life-Science
Qualitätsmanagement (QM)-System für Pharma und mehr...
Das Qualitätsmanagement in den Life Sciences stellt Unternehmen der Branche vor eine anspruchsvolle Aufgabe. Sie müssen komplexe, nationale und internationale Richtlinien für gute Arbeitspraxis einhalten und detailliert dokumentieren. Medizintechnikfirmen müssen nachweisen, dass sie all die Prozesse - Anforderungen erfüllen. Hierzu ghören auch die Computergestützten Systeme. Sie werden verstärkt im GxP-regulierten Bereich eingesetzt und ersetzen die manuelle Dokumentation. Eine Überwachung und detaillierte Dokumentation (Datenintegration / Rohdaten) ist für die wirkungsvolle Umsetzung und Anwendung im Rahmen der verschiedenen internationalen Richtlinien für gute Arbeitspraxis (GxP) sehr wichtig.
Unter den GxP-Normen werden zusammenfassend alle Richtlinien für „gute Arbeitspraxis“, welche insbesondere in der Medizin, der Pharmazie und der pharmazeutischen Chemie Bedeutung haben zusammengefasst.
Zu den GxP gehören unter anderem:
- Good Manufacturing Practice (GMP)
- Good Clinical Practice (GCP)
- Good Clinical Laboratory Practice (GCLP)
- Good Laboratory Practice (GLP)
- Good Automated Manufacturing Practice (GAMP)
- Good Documentation Practice (GDP)
- Good Engineering Practice (GEP)
- Good Pharmacovigilance Practice (GPvP)
Diese Richtlinien werden von der europäischen Europäischen Arzneimittelagentur und (EMA) amerikanischen Food and Drug Administration (FDA) Gesundheitsbehörde festgelegt. In Deutschland sind die Überwachungsbehörden der Länder für die Überwachung der Richtlinieneinhaltung zuständig. Die nötigen Informationen bzw. Zertifikate sind dieversen Datenbankenkonzetionell geordnet.
Wir die syntegris information solutions GmbH unterstützen Sie bei dem Design und der Einführung in Ihrem Unternehmen von IT Sytstemen.
Wir die syntegris Information solutions GmbH sind ein Dienstleister für Qualitätsmanagement, Qualitätskontrolle und Qualitätssicherung. Wir beraten pharmazeutische Unternehmen bei der Umsetzung der Richtlinien zur "guten Praxis", kurz GxP.
Wir sind nicht nur Experte und Oracle Gold Partner mit Spezialisierung auf Datenbanken sondern haben mittlerweile uns auch im gesamten GXP, GLP und GMP Bereich spezialisiert. Unsere Projekterfolge und Referenzen motivieren uns immer neue, spannende Herausforderungen, unter anderem auch im GxP und GMP zu suchen.
Syntegris unterstützt Sie und Ihre QPs dabei, diese Anforderungen effizient ins unternehmenseigene Qualitätsmanagement Daten zu integrieren, die GxP-Regeln einzuhalten und dies bei Inspektionen den Überwachungsbehörden auch nachzuweisen. Wir erstellen komplette GxP-Qualitätsmanagement-Systeme und beraten zur Qualitätssicherung.
- Wir übernehmen Verantwortung für ihre Einhaltung
- Sind Mitglied bei der GOMA
IT Compliance nach GLP, GMP
Wir unterstützen pharmazeutische Unternehmen das Advisory Dokument OECD17 umzusetzen.
Hierzu bieten wir an:
- Lifecycle Management für Labor-Applikationen im regulierten Umfeld - von der Projektierung, über den laufenden Betrieb bis zur Deregulierung.
- Unterstützung bei der Einführung von Archivierungslösungen
- Entwicklung von “Customized Solutions” mit Audittrail und Rollen-/ Rechte-Management.
Wir freuen uns in einem gemeinsamen Gespräch passende Lösungen für Sie zu finden.
„Die Gute Laborpraxis (GLP) (engl.: Good Laboratory Practice) ist ein Qualitätssicherungssystem, das sich mit dem organisatorischen Ablauf und den Rahmenbedingungen befasst, unter denen nicht-klinische gesundheits- und umweltrelevante Sicherheitsprüfungen geplant, durchgeführt und überwacht werden sowie mit der Aufzeichnung, Archivierung und Berichterstattung der Prüfungen.“ In vielen Ländern ist die GLP gesetzlich vorgeschrieben.
Innerhalb des Prozesses haben wir uns auf diese Schwerpunkte spezialisiert und unterstützen Unternehmen in der Pharma, Chemie, Biotechnologie, Medizinprodukte Branche, sowie die Zulieferer und Vertragspartner im Bezug auf Advisory Dokument OECD17.
Unsere GLP - Leistungen im Überblick:
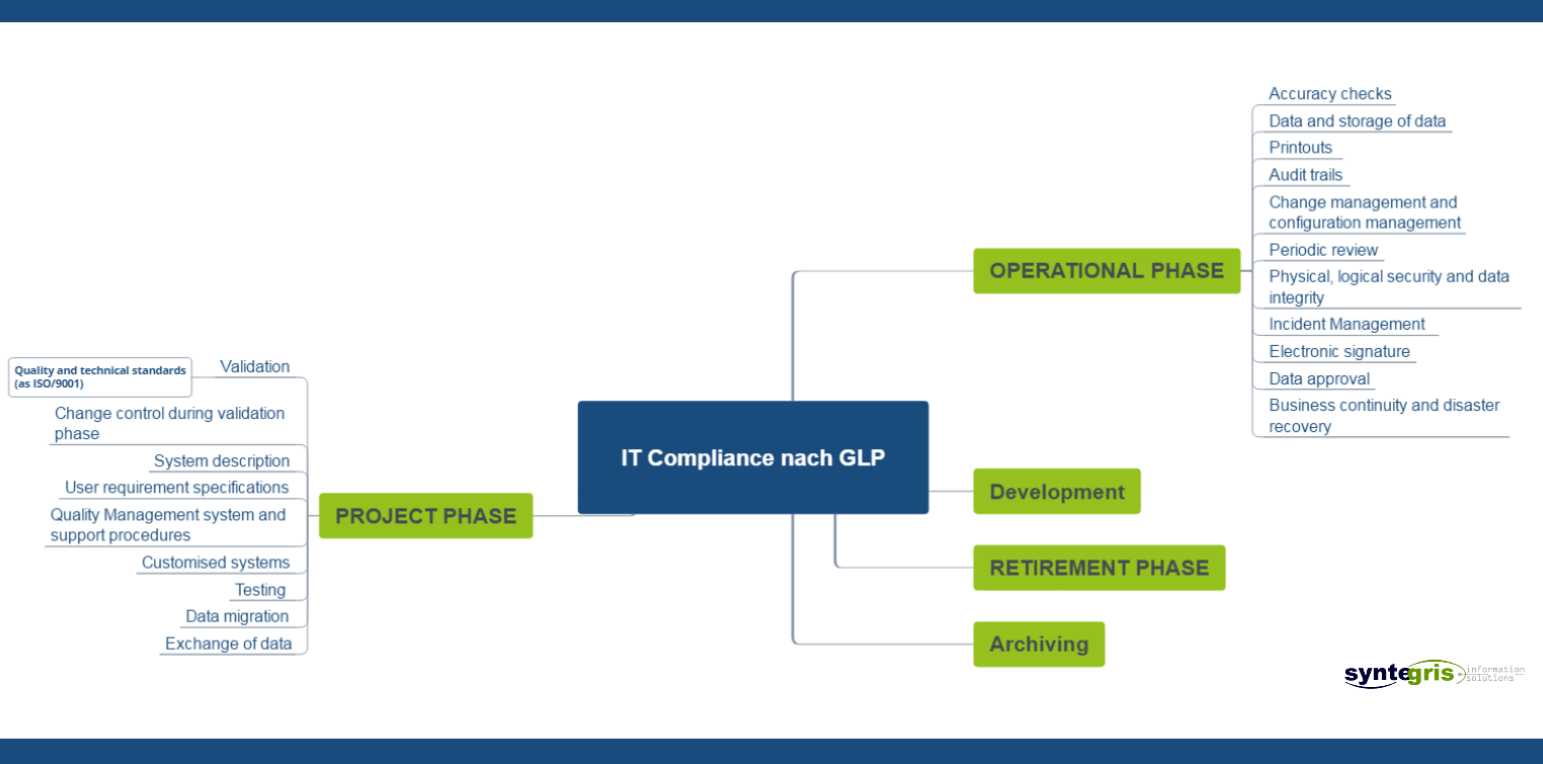
Sprechen Sie uns an und wir ermitteln gemeinsamen die passende Lösung für Sie:
Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein! oder direkt über unser Kontaktformular
In der pharmazeutischen Herstellung spielt die Qualitätssicherung und die gute Herstellungspraxis (englisch Good Manufacturing Practice, abgekürzt GMP)eine zentrale Rolle, da hier Qualitätsabweichungen direkte Auswirkungen auf die Gesundheit der Verbraucher haben können. Ein GMP-gerechtes Qualitätsmanagementsystem dient der Gewährleistung der Produktqualität und der Erfüllung der für die Vermarktung verbindlichen Anforderungen der Gesundheitsbehörden.
Wir unterstützen Sie bei der Erstellung, Review, Pflege von Dokumenten (SOPs) in Übereinstimmung mit den gesetzlichen Anforderungen.
Unsere GMP- Leistungen im Überblick:
- Bedarfsanalyse - GMP-Beratung
- Aufbau / Anpassung des Qualitätsmanagementsystems (QMS)
- Dokumentation und Erstellung von SOPs
- Archivierung von Dokumenten
- Erstellung von Richtlinien zu Systemvalidierung sowie der zughörigen SOPs
- Spezifikationen
- Qualifizierungsdokumente
- Erstellung des Validierungsplans und dem zugehörigen systemspezifischen SOPs
- Schulungsdokumente
Sprechen Sie uns an und wir ermitteln gemeinsamen die passende Lösung für Sie:
Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein! oder direkt über unser Kontaktformular.


